Ionkötés: az ellentétes töltésű ionok közötti elektrosztatikus vonzás.
- Rácsenergia: 1 mol kristályos anyag szabad, gáz-halmazállapotú ionokra bontásához szükséges energia.
- Az ionvegyületek képlete az ionok számarányát fejezi ki. Az ionok pozitív és negatív töltéseinek száma egyenlő, az ionkristályok kifelé elektromosan semlegesek.
A Chemical Romance...
Fémes kötés: a pozitív töltésű fématomtörzsek és a delokalizált elektronok közti elektrosztatikus vonzás. A fémes kötés annál erősebb, minél több elektron delokalizálódik, s minél kompaktabb a fémion.
(http://www.materials.unsw.edu.au/sites/default/files/metallic2_anim.gif)
Kovalens kötés: közös elektronpárral kialakított kapcsolat.
- Kötési energia: 1 mol molekulában 2 adott atom közti kötés felbontásához szükséges energia.
- Kötéshossz: a kötést létesítő atomok atommagjai közti távolság.
- Kötésszög: a kapcsolódó atomok kötései által bezárt szög.
Azok az ismeretek a kovalens kötésről, amit már általános iskolában megtanultál:
https://www.youtube.com/watch?v=_k_QtXTDpH4
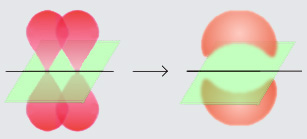
p-kötés: két atom között kialakuló második vagy harmadik kötés. A p-kötéseknek csomósíkja van, a kötésben részt vevő atomokra tudunk egy olyan síkot fektetni, ahol nem találhatóak meg az elektronok.
Datív kötés: olyan kovalens kötés, melyben a kötőelektronpár mindkét tagja az egyik atomtól származik.
Vegyérték: egyszerű molekulákban az adott atomhoz tartozó kötő elektronpárok száma.
Oldd meg a feladatot! Kis segítség: a baloldali ágrajzban a molekula szó, a jobb oldaliban a szárazjég kerül fölülre!
http://kfg.hu/~peti/kemia/FEJL_KEMIA/FEJL%20MAPPA%20K%C9MIA/FELADATOK-9/B18_9_3-0_12-32_18.pdf









its so cute. Help my assignment alot. Thank you.
VálaszTörlésits so cute. Help my assignment alot. Thank you.
VálaszTörlés